리튬-이온 배터리는 우리 삶 어디에나 있습니다. 스마트폰, 소형가전부터 전기자동차까지 리튬-이온 배터리는 오늘날 우리 삶을 구성하는 많은 것들에 사용되고 있습니다. 리튬-이온 배터리는 가벼운 중량과 높은 에너지 밀도 특성으로 고용량, 고효율 구현이 가능했기에 핵심 배터리로 채택되어 산업 전반에 사용되고 있습니다. 전기자동차의 배터리로도 가장 많이 사용되는 것이 리튬-이온 배터리입니다. 하지만 내연기관 자동차와의 경쟁에서 우위를 점하기 위해서 전기자동차는 점점 더 높은 에너지밀도를 필요로 하지만 리튬-이온 배터리로는 에너지밀도를 향상시키는데 한계가 있습니다. 그리고 이러한 한계를 극복하기 위해서 리튬-이온 배터리를 대체할 전지로 새롭게 주목받는 것이 바로 리튬-금속 배터리입니다. 이번 [공학, 미래를 IT다] 코너에서는 리튬-이온 배터리를 대체할 차세대 배터리로 기대를 받고 있는 리튬-금속 배터리에 대해 알아보겠습니다.
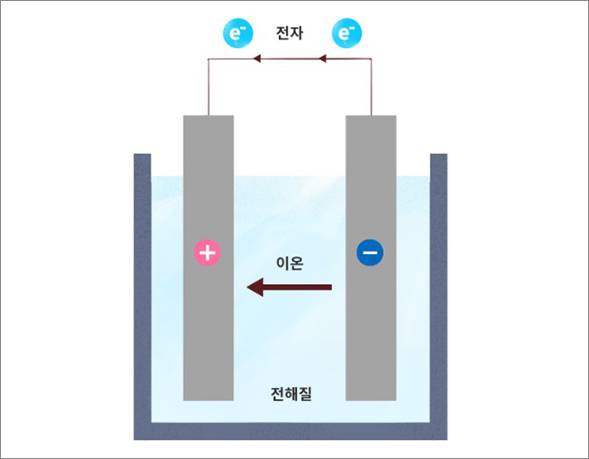
그림 1. 전지의 기본원리
1. 리튬-이온 배터리의 원리와 한계
리튬-금속 배터리에 대해 알아보기에 앞서 현재 주되게 사용되고 있는 리튬-이온 배터리에 대한 이해가 필요할 것 같습니다. 리튬-이온 배터리는 이차전지의 일종인데요, 이차전지란 일차전지와1 다르게 방전 후 충전해 반복 사용이 가능한 전지를 의미합니다. 전지의 기본 원리는 화학 에너지 준위가 다른 두 물질을 조합하여 전자의 이동을 유도하고 제어하는 것입니다. 전지는 [그림1]과 같이 화학 에너지 준위가 다른 두 물질과 부도체인 전해질로 구성이 되는데요. 전해질은 전자의 급작스러운 이동을 막기 위한 용매로 두 물질 사이에서 전자의 이동을 방지하고 양이온만 이동시키는 역할을 합니다. 전지를 구성하는 두 물질 간의 화학 에너지 준위 차에 따른 양이온의 이동으로 양극과 음극이 생기고 전선을 이용해 양극과 음극을 이어주면 전자는 전선을 통해 외부로 흐르면서 전기에너지가 발생하게 됩니다.
리튬-금속 배터리에 대해 알아보기에 앞서 현재 주되게 사용되고 있는 리튬-이온 배터리에 대한 이해가 필요할 것 같습니다. 리튬-이온 배터리는 이차전지의 일종인데요, 이차전지란 일차전지와1 다르게 방전 후 충전해 반복 사용이 가능한 전지를 의미합니다. 전지의 기본 원리는 화학 에너지 준위가 다른 두 물질을 조합하여 전자의 이동을 유도하고 제어하는 것입니다. 전지는 [그림1]과 같이 화학 에너지 준위가 다른 두 물질과 부도체인 전해질로 구성이 되는데요. 전해질은 전자의 급작스러운 이동을 막기 위한 용매로 두 물질 사이에서 전자의 이동을 방지하고 양이온만 이동시키는 역할을 합니다. 전지를 구성하는 두 물질 간의 화학 에너지 준위 차에 따른 양이온의 이동으로 양극과 음극이 생기고 전선을 이용해 양극과 음극을 이어주면 전자는 전선을 통해 외부로 흐르면서 전기에너지가 발생하게 됩니다.
1 한번 방전해 버리면 충전해서 재사용 할 수 없는 전지.
이차전지인 리튬-이온 배터리는 양극과 음극이 번갈아 층을 이루고 있는 전극소재로 구성되어 있고 층 사이에 양이온의 일종인 리튬 이온이 전착되면서 양극과 음극 사이에 전위차가 발생하게 됩니다. 리튬-이온 배터리의 구성 요소는 크게 양극, 음극, 전해질 그리고 분리막 네 가지로 분류할 수 있습니다. 우선 양극은 리튬 이온을 제공하는 극으로 리튬은 원소 상태에서 반응이 불안정하여 산소가 결합된 리튬 산화물이 양극에 사용됩니다. 다음으로 음극은 양극에서 나온 리튬 이온을 흡수∙방출하는 극으로 리튬 이온을 보관하는 상자 역할을 합니다. 음극은 탄소 소재들 그 중에서 대표적으로 흑연으로 구성되어 있습니다. 전해질은 리튬 이온의 이동을 가능하게 하는 물질로 리튬 이온과 결합하여 양극에서 음극으로 이동합니다. 리튬-이온 배터리의 전해질은 유기용매2에 리튬염3이 용해된 액체 형태로 되어 있습니다. 마지막으로 분리막은 양극과 음극의 물리적 접촉을 차단하는 역할을 합니다. 분리막에 있는 미세한 구멍을 통해 리튬 이온만이 양극과 음극 사이를 이동할 수 있습니다.
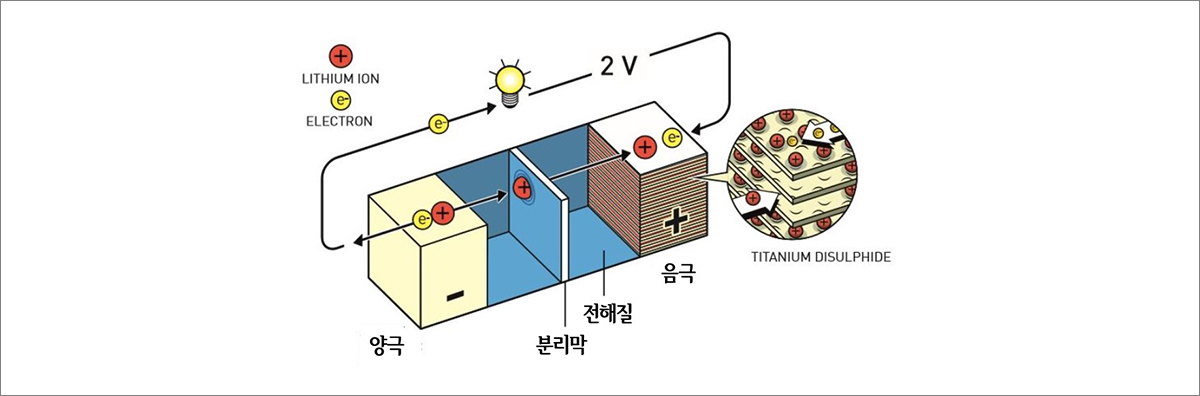
그림 2. 리튬-이온 배터리의 구조
리튬-이온 배터리는 현재 상용화된 이차전지 중 성능이 가장 뛰어납니다. 그 이유는 리튬-이온 배터리는 다른 배터리에 비해 에너지밀도가 높기 때문입니다. 에너지 밀도는 단위 무게당 배터리가 가질 수 있는 에너지의 용량을 뜻하는 척도로 에너지밀도가 높기 위해서는 배터리의 양극재에 저장할 수 있는 전하의 양이 많아야 합니다. 리튬-이온 배터리는 상대적으로 많은 리튬 이온을 양극재에 저장할 수 있기 때문에 에너지 밀도가 높은 것입니다. 하지만 동시에 리튬-이온 배터리의 이론적인 용량은 정해져 있고 그 이상으로 에너지 밀도를 높일 수 없다는 명확한 한계를 가지고 있습니다. 전기자동차가 여전히 주행 거리가 짧으며 충전이 느린 불편한 존재로 인식되는 이유도 리튬-이온 배터리가 가진 에너지 밀도의 한계 때문입니다. 그리고 이 한계를 극복하기 위해서는 리튬-이온 배터리의 발전이 아닌 새로운 배터리로의 대체가 필요합니다.
2 어떤 물질을 녹일 수 있는 액체상태의 유기물질. 전해질의 유기용매는 리튬염을 잘 용해시키는 특성이 있다.
3 리튬 이온이 이동할 수 있는 일종의 통로 역할을 수행함. 현재 보편적으로 적용되는 리튬염의 화학식은 LiPF6
2. 리튬-이온 배터리를 대체할 리튬-금속 배터리
리튬-이온 배터리를 대체할 리튬-금속 배터리 기술의 핵심은 리튬-이온 배터리에서 음극을 구성했던 흑연을 리튬-금속으로 대체하는 것입니다. 흑연의 층상 구조는 충전 시 리튬이온을 흡수하여도 부피 팽창이 작아 긴 사이클 수명을 가지게 해주어 리튬-이온 배터리에서 음극재로 사용되었습니다. 이때 흑연은 탄소 원자 6개당 하나의 리튬 이온을 저장할 수 있고, 이를 토대로 음극에서 사용되는 흑연의 최대 리튬 저장량인 흑연의 이론용량을 계산하면 372mAh/g이 됩니다. 하지만 배터리의 음극을 리튬-금속으로 대체한다면 이론적으로 흑연의 10배가량인 3,860mAh/g 용량의 리튬을 저장할 수 있기 때문에 전지의 에너지 밀도가 크게 증가할 수 있습니다. 또한 흑연이 차지하는 물리적 공간은 리튬 이온을 보관하는 역할만 할 뿐 에너지를 저장하지도 않고 전류를 생성하지도 않아 불필요하지만, 리튬-금속이 차지하는 물리적 공간은 거의 모두 전류를 생성하는 원자로 채워질 수 있습니다. 그러므로 동일한 무게와 부피에 대하여 이론적으로 리튬-금속 음극은 흑연 음극에 비해 50% 더 많은 에너지를 저장할 수 있습니다. 더 빠르게 충전할 수 있으며, 더 오래가는 전기자동차의 개발을 위해서 리튬-이온 배터리를 대체할 배터리 연구의 필요성이 확실하며 그것으로 주목을 받는 차세대 배터리가 리튬-금속 배터리인 이유가 여기에 있습니다.
리튬-이온 배터리를 대체할 리튬-금속 배터리 기술의 핵심은 리튬-이온 배터리에서 음극을 구성했던 흑연을 리튬-금속으로 대체하는 것입니다. 흑연의 층상 구조는 충전 시 리튬이온을 흡수하여도 부피 팽창이 작아 긴 사이클 수명을 가지게 해주어 리튬-이온 배터리에서 음극재로 사용되었습니다. 이때 흑연은 탄소 원자 6개당 하나의 리튬 이온을 저장할 수 있고, 이를 토대로 음극에서 사용되는 흑연의 최대 리튬 저장량인 흑연의 이론용량을 계산하면 372mAh/g이 됩니다. 하지만 배터리의 음극을 리튬-금속으로 대체한다면 이론적으로 흑연의 10배가량인 3,860mAh/g 용량의 리튬을 저장할 수 있기 때문에 전지의 에너지 밀도가 크게 증가할 수 있습니다. 또한 흑연이 차지하는 물리적 공간은 리튬 이온을 보관하는 역할만 할 뿐 에너지를 저장하지도 않고 전류를 생성하지도 않아 불필요하지만, 리튬-금속이 차지하는 물리적 공간은 거의 모두 전류를 생성하는 원자로 채워질 수 있습니다. 그러므로 동일한 무게와 부피에 대하여 이론적으로 리튬-금속 음극은 흑연 음극에 비해 50% 더 많은 에너지를 저장할 수 있습니다. 더 빠르게 충전할 수 있으며, 더 오래가는 전기자동차의 개발을 위해서 리튬-이온 배터리를 대체할 배터리 연구의 필요성이 확실하며 그것으로 주목을 받는 차세대 배터리가 리튬-금속 배터리인 이유가 여기에 있습니다.
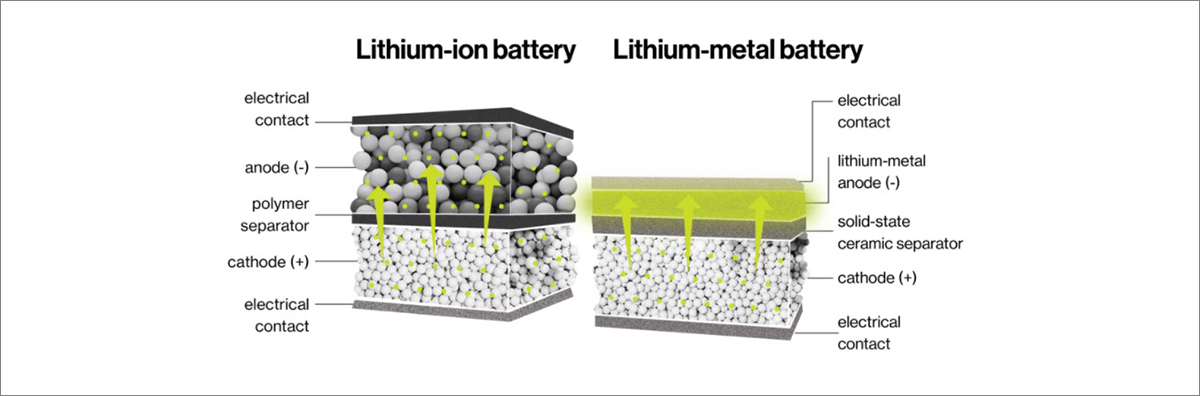
그림3. 리튬-이온 배터리와 리튬-금속 배터리의 비교
하지만 리튬-금속 배터리는 불안정하다는 단점을 가지고 있습니다. 리튬-금속은 높은 전기화학적 반응성을 가지고 있어 리튬 이온을 전달하는 액체 전해액과 경계면을 형성할 경우 유기용매 또는 리튬염과 반응을 하게 됩니다. 이때 경계면에서 용해되지 않는 성분들이 모여서 다층적인 막을 형성합니다. 이렇게 경계면이 조성된 리튬-금속에 리튬이 접촉할 경우, 균일하지 않고 부분적으로 리튬이 쌓이게 됩니다. 더욱이 막이 부서지면서 마치 뾰족한 나뭇가지와 같은 형태로 잔해 결정이 자라나게 됩니다. 이렇게 자라난 결정은 리튬-금속 배터리의 충전∙방전 효율을 낮추고, 심각할 경우에는 분리막을 뚫고 양극과 닿아 전지의 발화 및 폭발을 야기할 수 있습니다.
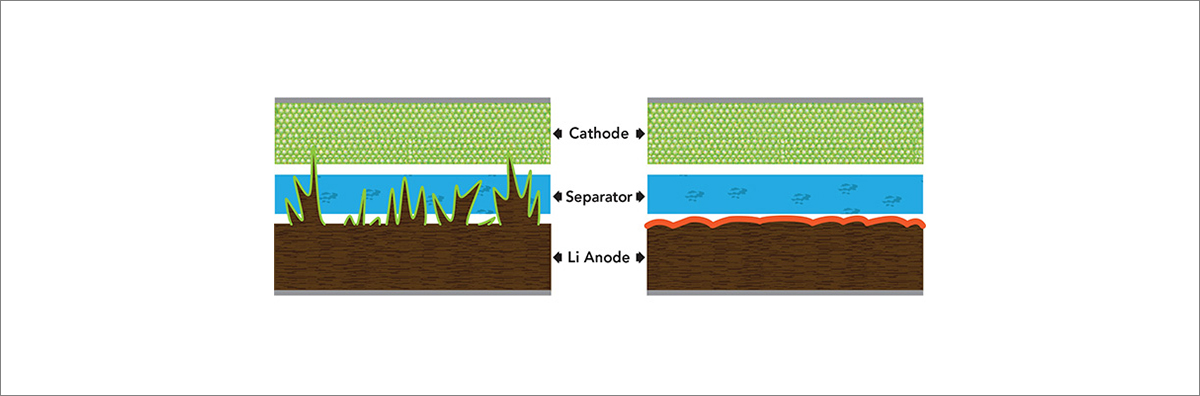
그림4. 뾰족하게 자라난 리튬-금속 배터리의 잔해 결정
리튬-금속 배터리의 안정성 문제를 해결하기 위한 방안 중 하나로 액체 전해질 대신에 고체 전해질을 사용하여 발화의 위험을 없앤 전고체 배터리에 대한 연구가 진행되고 있습니다. 최근 배터리 소재 기술을 연구하는 기업 퀀텀 스페이스에서 이러한 전고체형의 리튬-금속 배터리를 개발했다는 발표를 하였습니다. 이는 단층 배터리 셀에서의 성과로, 차량에 적용하려면 수십 겹의 층이 들어찬 배터리를 생산해야 하기에 아직은 발전해야 할 부분이 많습니다. 하지만 리튬-금속 배터리 시대가 곧 도래할 것임을 꿈꾸게 합니다.
자동차 역사에서 전기자동차의 운명을 좌우했던 핵심부품은 배터리였습니다. 리튬-이온 배터리가 리튬-금속 배터리로 전환된다면 전기자동차가 내연기관 자동차를 대체할 날도 멀지 않은 것 같습니다. 어느새 빨갛게 변해버린 휴대전화의 배터리 게이지를 보며 아직은 배터리의 한계를 절실히 느끼지만 기술이 발전하여 리튬-금속 배터리가 배터리 걱정 없는 미래로 우리를 안내해줄 것을 기대합니다.
자동차 역사에서 전기자동차의 운명을 좌우했던 핵심부품은 배터리였습니다. 리튬-이온 배터리가 리튬-금속 배터리로 전환된다면 전기자동차가 내연기관 자동차를 대체할 날도 멀지 않은 것 같습니다. 어느새 빨갛게 변해버린 휴대전화의 배터리 게이지를 보며 아직은 배터리의 한계를 절실히 느끼지만 기술이 발전하여 리튬-금속 배터리가 배터리 걱정 없는 미래로 우리를 안내해줄 것을 기대합니다.
- 참고자료
- [1] 이재원∙김우병, 「리튬이차전지 전극소재 연구동향」, 2014
- [2] James Temple, 리튬금속 배터리, 전기차 전환 앞당긴다, MIT Technology Review, 2021.03.10
- [3] 김영식, 리튬이온전지의 원리와 탄생 그리고 노벨상, HORIZON, 2020.03.25
- [4] 유승호, 안정한 리튬금속음극 개발
- [4] 김희탁, 차세대 리튬금속음극 보호막 기술동향, 공업화학 전망, 제21권 제6호, 2018
- 그림 출처
- 그림1) 김영식, 리튬이온전지의 원리와 탄생 그리고 노벨상, HORIZON, 2020.03.25
- 그림2) Ann Fernholm, They developed the world’s most powerful battery, The Novel Prize
- 그림3) James Temple, 리튬금속 배터리, 전기차 전환 앞당긴다, MIT Technology Review, 2021.03.10
- 그림4) Charles Morris, Researchers add compounds to electrolyte to prevent dendrite growth, The Tech, 2015.6.29


