
그림 1. 에마뉘엘 샤르팡티에(왼쪽)와
제니퍼 다우드나(오른쪽)
제니퍼 다우드나(오른쪽)
<INTRO>
서울대 입학본부 웹진 아로리에 따르면, 2022학년도 서울대 지원자들이 2번째로 많이 읽은 책은 올더스 헉슬리의 <멋진 신세계>라고 합니다. 자주 인용되는 고전이라 SF 장르를 좋아하는 독자 분들은 이미 한 번씩 읽어 보셨을 것 같습니다. <멋진 신세계> 속 사람들은 유전자가 편집되어, 정해진 계급에 만족하고 안주하도록 태어납니다. 유전자가 정확히 무엇인지도 모를 때부터 인류는 생물의 근간을 건드리고 싶어했고, 그러면서 유전자 조작 기술이 실현되었을 때 생길 결과들을 두려워하기도 했습니다.
서울대 입학본부 웹진 아로리에 따르면, 2022학년도 서울대 지원자들이 2번째로 많이 읽은 책은 올더스 헉슬리의 <멋진 신세계>라고 합니다. 자주 인용되는 고전이라 SF 장르를 좋아하는 독자 분들은 이미 한 번씩 읽어 보셨을 것 같습니다. <멋진 신세계> 속 사람들은 유전자가 편집되어, 정해진 계급에 만족하고 안주하도록 태어납니다. 유전자가 정확히 무엇인지도 모를 때부터 인류는 생물의 근간을 건드리고 싶어했고, 그러면서 유전자 조작 기술이 실현되었을 때 생길 결과들을 두려워하기도 했습니다.
유전자 조작 기술에 대한 논의는 2012년, 크리스퍼 유전자가위(CRISPR-CAS9, 이하 크리스퍼 기술)가 등장하면서 새로운 국면을 맞았습니다. 유전자 편집이 인류 역사상 최고로 간편해졌다며, 이 기술의 가능성에 대해 각계각층의 사람들이 논의했습니다. 불과 8년이 지난 2020년, 제니퍼 다우드나 (Jennifer A. Doudna) UC버클리 교수는 에마뉘엘 샤르팡티에 (Emmanuelle Charpentier) 막스플랑크연구소 교수와 함께 크리스퍼 기술의 발명에 대한 공로로 노벨상을 수상하였습니다. 크리스퍼 기술은 얼마나 혁신적이기에 유전자 편집에 대한 논란에도 불구하고 노벨상을 수상한 걸까요? 함께 알아보겠습니다.
<CRISPR-CAS9>
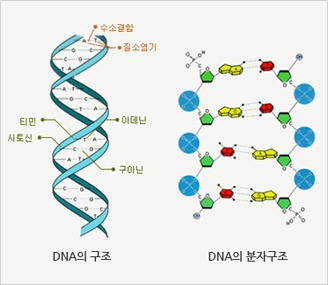
그림 2. DNA의 구조
생물의 유전정보는 세포 속 DNA 사슬, 정확히는 [그림 2]와 같은 사다리 형태 중 가로대에 해당하는 염기 서열에 저장되어 있습니다. 생물의 몸 구조, 물질대사, 생장과 분화 등을 총괄하는 DNA는 상황에 따라 필요한 내용이 부분적으로 전사와 번역이라는 과정으로 된 후, 단백질의 형태로 활용됩니다. 그런데 DNA가 바이러스에 감염될 경우 DNA는 훼손됩니다.
바이러스는 스스로 자신의 유전정보를 퍼트릴 수 없기 때문에, 다른 생물의 DNA에 자신의 유전 정보를 끼워 넣어 번식합니다. 인간과 같은 동물이나 식물 세포는 DNA를 핵 속에 넣어 바이러스감염이나 손상으로부터 보호합니다. 하지만 원핵생물1 의 경우, 핵이 없는데도 바이러스에 절멸하지 않고 계속 살아갑니다. 생물학자들은 원핵생물이 스스로를 바이러스로부터 보호하는 면역 체계에 대해 연구해 왔고, 제니퍼 다우드나는 그런 사람 중 하나였습니다.
바이러스는 스스로 자신의 유전정보를 퍼트릴 수 없기 때문에, 다른 생물의 DNA에 자신의 유전 정보를 끼워 넣어 번식합니다. 인간과 같은 동물이나 식물 세포는 DNA를 핵 속에 넣어 바이러스감염이나 손상으로부터 보호합니다. 하지만 원핵생물1 의 경우, 핵이 없는데도 바이러스에 절멸하지 않고 계속 살아갑니다. 생물학자들은 원핵생물이 스스로를 바이러스로부터 보호하는 면역 체계에 대해 연구해 왔고, 제니퍼 다우드나는 그런 사람 중 하나였습니다.
1 핵이 없는 생물들로, 대장균 등의 세균이 포함됨
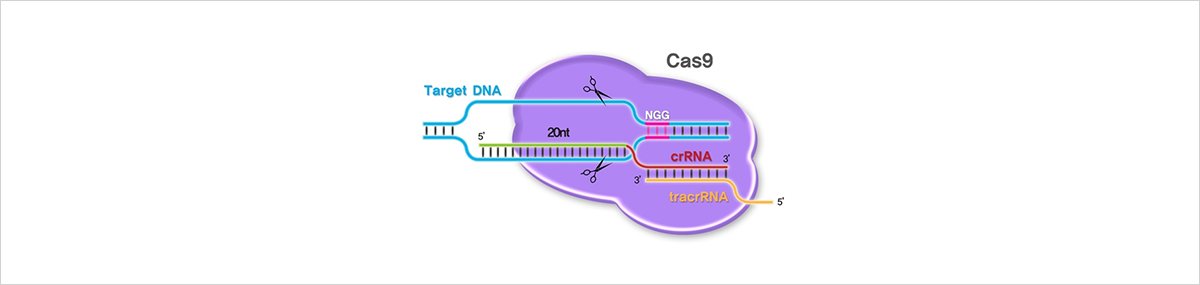
그림 3. CAS9의 작동 원리
크리스퍼 기술의 정확한 이름은 CRISPR-CAS9으로, 이 중 CRISPR와 CAS9은 각각 원핵생물 면역계의 한 부분을 의미합니다. CRISPR는 바이러스가 침투했을 때 원핵생물이 바이러스를 기억하기 위해 DNA에 적어 놓은 표시입니다. 원핵생물은 새로운 바이러스를 발견하면 자신의 DNA에 바이러스 DNA를 삽입하고, 이 부분을 CRISPR로 표시합니다. CAS 단백질은 CRISPR가 알려 준 바이러스 DNA를 감지했을 때 이를 분해하는 효소입니다. CRISPR로 표시된 바이러스 DNA로부터 crRNA라는 RNA가 생성되며, crRNA은 CAS 단백질과 결합하여 바이러스 DNA를 인식하고 파괴하도록 돕습니다. 다우드나의 연구팀은 crRNA가 CAS 단백질과 결합할 자리에 다른 RNA를 삽입할 수 있으며, 이렇게 했을 때 DNA의 원하는 서열을 잘라낼 수 있다는 것을 발견했습니다. 또한, 잘린 DNA 근처에 원하는 조합의 DNA를 두면 주변 DNA를 토대로 손상을 복구하는 DNA 복구 시스템이 작동하여 연구자가 첨가한 DNA가 삽입된 채로 DNA가 재조립되는 것도 발견했습니다. 이렇게 원핵생물의 면역 시스템 요소 2가지를 합쳐 발명된 것이 CRISPR-CAS9 기술입니다.
크리스퍼 기술이 처음 발표된 것은 2012년이고, 다우드나 교수가 노벨상을 수상한 것은 발표로부터 불과 8년 후인 2020년입니다. 노벨상 수상 결정은 대개 발견/발명으로부터 수십 년 후라는 것을 생각하면, 다우드나 교수의 수상은 이례적입니다. 노벨상 수상이 이렇게 빠르게 결정된 것은 크리스퍼가 끼친 영향, 특히 의료 분야에서의 영향 때문이라고 합니다.
크리스퍼 기술이 처음 발표된 것은 2012년이고, 다우드나 교수가 노벨상을 수상한 것은 발표로부터 불과 8년 후인 2020년입니다. 노벨상 수상 결정은 대개 발견/발명으로부터 수십 년 후라는 것을 생각하면, 다우드나 교수의 수상은 이례적입니다. 노벨상 수상이 이렇게 빠르게 결정된 것은 크리스퍼가 끼친 영향, 특히 의료 분야에서의 영향 때문이라고 합니다.
<왜 노벨상인가? - 크리스퍼와 의료>

그림 4. 빅토리아 그레이 씨. 크리스퍼로 낫모양적혈구 빈혈증을 치료받은 환자 중 하나다.
쉽고 빠르게 DNA 서열을 조작할 수 있는 크리스퍼 기술의 발명 이후, 크리스퍼 기술의 덕을 본 의료 사례들이 쏟아져 나왔습니다. 낫모양적혈구 빈혈증, 암모니아 대사 이상 등 선천성 유전병은 이전까지는 근본적 원인을 알면서도 치료하기 힘들었습니다. 하지만 크리스퍼 기술의 등장으로 완전한 치료의 가능성이 생겼고, 실제로 성공적인 임상 사례도 여럿 나왔습니다. 유전자 치료 과정에서 심한 면역 반응을 일으킨 환자가 사망하는 사고가 벌어져 유전자 치료 연구에 제동이 걸리는 듯하기도 했지만, 질환의 원인을 직접 없앨 수 있는 기술이기에 크리스퍼 기술을 이용하는 의료 연구는 계속될 전망입니다.
크리스퍼 기술이 의학에서 특히 주목받는 이유는 의료 연구의 방향성과도 연관이 있습니다. 이전의 의료는 통계적으로 많은 사람에게 효과가 있는 약물을 처방하고, 문제가 생길 경우 약물을 바꾸는 방식으로 이루어졌습니다. 하지만 투약의 기회비용이 크거나 질병 자체가 희귀한 질병인 경우, 이러한 방식의 의료는 안정성이나 금전 측면에서 적용이 어렵습니다. 이를 보완하기 위한 패러다임이 맞춤 정밀의학입니다.
맞춤 정밀의학에서는 환자의 병증과 신체 특성을 먼저 관찰하고, 환자에 최적화된 의약품을 만듭니다. 즉, 과거에는 대량생산을 통해 간단한 분자 단위의 의약품을 사용했지만, 현대에는 환자에게 맞춘 의약품을 다품종 소량 생산하는 방향으로 의약품 산업이 변화하고 있습니다. 사용할 수 있는 의료 기술의 종류도 환자의 몸속 세포를 직접 조작하거나, 환자에게서 세포를 꺼낸 뒤 유전자 편집을 거쳐 다시 몸에 넣거나, 복잡한 구조의 단백질을 투여하는 등으로 다양합니다. 이때 환자의 유전자를 조작하거나 미생물로부터 단백질을 생산할 때 크리스퍼 기술을 사용하면 의약품 생산 비용과 시간을 획기적으로 줄일 수 있습니다. 이런 크리스퍼 기술의 장점 덕에 신세대 의약품의 상용화가 한 걸음 더 가까워졌습니다. 하지만 모든 기술이 그렇듯 크리스퍼 기술에도 그림자는 있습니다.
크리스퍼 기술이 의학에서 특히 주목받는 이유는 의료 연구의 방향성과도 연관이 있습니다. 이전의 의료는 통계적으로 많은 사람에게 효과가 있는 약물을 처방하고, 문제가 생길 경우 약물을 바꾸는 방식으로 이루어졌습니다. 하지만 투약의 기회비용이 크거나 질병 자체가 희귀한 질병인 경우, 이러한 방식의 의료는 안정성이나 금전 측면에서 적용이 어렵습니다. 이를 보완하기 위한 패러다임이 맞춤 정밀의학입니다.
맞춤 정밀의학에서는 환자의 병증과 신체 특성을 먼저 관찰하고, 환자에 최적화된 의약품을 만듭니다. 즉, 과거에는 대량생산을 통해 간단한 분자 단위의 의약품을 사용했지만, 현대에는 환자에게 맞춘 의약품을 다품종 소량 생산하는 방향으로 의약품 산업이 변화하고 있습니다. 사용할 수 있는 의료 기술의 종류도 환자의 몸속 세포를 직접 조작하거나, 환자에게서 세포를 꺼낸 뒤 유전자 편집을 거쳐 다시 몸에 넣거나, 복잡한 구조의 단백질을 투여하는 등으로 다양합니다. 이때 환자의 유전자를 조작하거나 미생물로부터 단백질을 생산할 때 크리스퍼 기술을 사용하면 의약품 생산 비용과 시간을 획기적으로 줄일 수 있습니다. 이런 크리스퍼 기술의 장점 덕에 신세대 의약품의 상용화가 한 걸음 더 가까워졌습니다. 하지만 모든 기술이 그렇듯 크리스퍼 기술에도 그림자는 있습니다.
<유전자 조작과 윤리>
2018년, 중국의 생명공학자 허젠쿠이 교수가 크리스퍼 기술을 통해 HIV2 에 면역을 갖도록 인간 아기의 유전자를 조작했다고 발표하여 논란이 되었습니다. 허젠쿠이 교수는 결국 불법 의료행위로 3년의 징역과 벌금형을 선고받았습니다. 그의 유전자 편집이 큰 논란을 불러일으킨 이유는 생식세포/배아 유전자를 편집할 경우 그 영향이 미래 세대에까지 지속되기 때문입니다.
인간 생식세포 유전자 조작에 대한 우려가 크리스퍼 기술 이전에 존재하지 않았던 것은 아닙니다. 크리스퍼 기술이 ‘3세대 유전자 가위’로 불리는 점에서 알 수 있듯, 이미 ZFN(zinc finger nuclease), TALEN(Transcriptor Activator-Like Effector Nuclease)과 같은 유전자 가위들이 존재하였고, 서열 단위 조작이 아니라 유전자를 통째로 떼고 붙이는 기술은 그 이전부터 활용되어 왔습니다. 유전자 조작이라는 개념 자체도 실제로 기술이 실현되기 전부터 기대와 우려의 대상이 되었습니다.
유전자 조작의 대상이 인간이 아닌 경우라도 문제가 있는 것은 마찬가지입니다. 유전자 편집으로 만들어진 작물들은 살충제에 내성이 있고 생산성이 높아서 인류의 식량 확보에 지대한 도움을 주고 있지만, 이러한 작물이 통제 불가능한 범위로 퍼져 생태계를 파괴할 우려가 있습니다. 인간의 유전자 풀을 인위적으로 바꾸는 것이 문제가 된다면, 다른 생물종의 유전자 풀을 바꾸는 것은 어째서 이미 용인되었는가에 대한 철학적 질문들도 존재합니다.
2018년, 중국의 생명공학자 허젠쿠이 교수가 크리스퍼 기술을 통해 HIV2 에 면역을 갖도록 인간 아기의 유전자를 조작했다고 발표하여 논란이 되었습니다. 허젠쿠이 교수는 결국 불법 의료행위로 3년의 징역과 벌금형을 선고받았습니다. 그의 유전자 편집이 큰 논란을 불러일으킨 이유는 생식세포/배아 유전자를 편집할 경우 그 영향이 미래 세대에까지 지속되기 때문입니다.
인간 생식세포 유전자 조작에 대한 우려가 크리스퍼 기술 이전에 존재하지 않았던 것은 아닙니다. 크리스퍼 기술이 ‘3세대 유전자 가위’로 불리는 점에서 알 수 있듯, 이미 ZFN(zinc finger nuclease), TALEN(Transcriptor Activator-Like Effector Nuclease)과 같은 유전자 가위들이 존재하였고, 서열 단위 조작이 아니라 유전자를 통째로 떼고 붙이는 기술은 그 이전부터 활용되어 왔습니다. 유전자 조작이라는 개념 자체도 실제로 기술이 실현되기 전부터 기대와 우려의 대상이 되었습니다.
유전자 조작의 대상이 인간이 아닌 경우라도 문제가 있는 것은 마찬가지입니다. 유전자 편집으로 만들어진 작물들은 살충제에 내성이 있고 생산성이 높아서 인류의 식량 확보에 지대한 도움을 주고 있지만, 이러한 작물이 통제 불가능한 범위로 퍼져 생태계를 파괴할 우려가 있습니다. 인간의 유전자 풀을 인위적으로 바꾸는 것이 문제가 된다면, 다른 생물종의 유전자 풀을 바꾸는 것은 어째서 이미 용인되었는가에 대한 철학적 질문들도 존재합니다.
2 인간면역결핍 바이러스. AIDS를 일으키는 병원체이다.
<OUTRO>
CRISPR-CAS9을 발견한 뒤 다우드나 교수는 일약 유명인사가 되었습니다. 앞서 CAS9 단백질은 병원체의 DNA를 파괴하는 원핵생물의 능력과 관련되어 있다고 설명했습니다. 다우드나 교수는 2012년 이후로도 CAS9처럼 원핵생물의 면역계와 관련된 CAS 단백질의 작동 원리를 규명하고, 그 활용 방안을 찾는 연구들을 해 왔습니다. 2020년 신종코로나바이러스(이하 코로나19) 사태가 발생하자, 여태까지의 연구를 토대로 코로나19 진단 시스템을 개발하기도 했습니다.
다우드나 교수는 자신이 개척한 기술이 올바르게 쓰이도록 사회적 메시지를 전하는 데에도 많은 노력을 기울였습니다. 그는 크리스퍼 기술이 인간 질병 치료에 미칠 긍정적인 영향과 그럼에도 아직 알 수 없는 위험들, 그리고 신기술이 부유한 사람들에게 독점되어서는 안 된다는 메시지들을 지속적으로 전달하고 있습니다.
아직 해결해야 할 문제가 많긴 하지만, 크리스퍼 기술은 사람을 살리는 도구로서 노벨상을 수상했습니다. 크리스퍼 기술이 이로운 기술이 될 수 있었던 건 다우드나 교수가 과학자의 사회적 책임을 잘 지켰기 때문일 것입니다. 미래의 과학자, 공학자가 될 독자님들도 제니퍼 다우드나의 열정과 함께 그 책임감도 본받아 보는 건 어떨까요?
CRISPR-CAS9을 발견한 뒤 다우드나 교수는 일약 유명인사가 되었습니다. 앞서 CAS9 단백질은 병원체의 DNA를 파괴하는 원핵생물의 능력과 관련되어 있다고 설명했습니다. 다우드나 교수는 2012년 이후로도 CAS9처럼 원핵생물의 면역계와 관련된 CAS 단백질의 작동 원리를 규명하고, 그 활용 방안을 찾는 연구들을 해 왔습니다. 2020년 신종코로나바이러스(이하 코로나19) 사태가 발생하자, 여태까지의 연구를 토대로 코로나19 진단 시스템을 개발하기도 했습니다.
다우드나 교수는 자신이 개척한 기술이 올바르게 쓰이도록 사회적 메시지를 전하는 데에도 많은 노력을 기울였습니다. 그는 크리스퍼 기술이 인간 질병 치료에 미칠 긍정적인 영향과 그럼에도 아직 알 수 없는 위험들, 그리고 신기술이 부유한 사람들에게 독점되어서는 안 된다는 메시지들을 지속적으로 전달하고 있습니다.
아직 해결해야 할 문제가 많긴 하지만, 크리스퍼 기술은 사람을 살리는 도구로서 노벨상을 수상했습니다. 크리스퍼 기술이 이로운 기술이 될 수 있었던 건 다우드나 교수가 과학자의 사회적 책임을 잘 지켰기 때문일 것입니다. 미래의 과학자, 공학자가 될 독자님들도 제니퍼 다우드나의 열정과 함께 그 책임감도 본받아 보는 건 어떨까요?
- 참고자료
-
-
[1] https://www.youtube.com/embed/KSrSIErIxMQ
[2] https://www.sciencetimes.co.kr/news/%EC%98%AC%ED%95%B4-%EB%85%B8%EB%B2%A8%ED%99%94%ED%95%99%EC%83%81%EC%97%90%EC%84%9C-%ED%8A%B9%EA%B8%B0%ED%95%A0%EB%A7%8C%ED%95%9C-%EC%A0%90%EB%93%A4%EC%9D%80/
[3] 월터 아이작슨,<코드 브레이커>
[4] https://www.donga.com/news/It/article/all/20220701/114234559/1
[5] 이기형 외, <바이오사이언스의 이해>
[6] 제니퍼 다우드나, 새뮤얼 스턴버그, <크리스퍼가 온다>
[7] http://m.dongascience.com/news.php?idx=58490
[8] https://www.hani.co.kr/arti/science/science_general/1032831.html
- 그림출처
-
그림 1. 에마뉘엘 샤르팡튀에(왼쪽), 제니퍼 다우드나(오른쪽) https://www.sciencetimes.co.kr/news/%EC%9C%A0%EC%A0%84%EC%9E%90%EA%B0%80%EC%9C%84-%EA%B0%9C%EB%B0%9C%ED%95%9C-%EB%91%90-%EC%97%AC%EC%84%B1-%EB%85%B8%EB%B2%A8%ED%99%94%ED%95%99%EC%83%81-%EC%88%98%EC%83%81/
그림 2. DNA의 구조 https://www.nifs.go.kr/lmo/lmo/lmo4_12.lmo
그림 3. CAS9의 원리 https://www.medifonews.com/news/article_print.html?no=138365
그림 4. https://www.npr.org/sections/health-shots/2023/03/16/1163104822/crispr-gene-editing-sickle-cell-success-cost-ethics


