콜라와 우유를 섞으면
깨끗한 물이 된다고?
오늘은 괴짜 공대생과 함께 예측할 수 없는 조합인 콜라와 우유를 통해 깨끗한 물을 만들어보고자 합니다. 많은 물질이 섞여 있어 일상생활 속 우리가 흔히 마시는 물과 거리가 멀어 보이는 두 혼합물 콜라와 우유. 이 두 액체를 섞는 과정이 놀랍게도 우리가 마실 수 있는 물을 만드는 정수 과정과 일부 같답니다! 괴짜 공대생과 함께 직접 실험하고 원리를 공부해봅시다!



실험 준비물은 위의 그림과 같습니다. 함께 섞을 우유와 콜라, 그리고 정수 과정에 필요한 도구들과 더욱 완성도 높은 정수를 위한 활성탄을 준비했습니다.
우선 콜라와 우유를 약 2:1로 혼합하면 그림과 같이 덩어리가 생기게 됩니다. 콜라와 우유의 이온들이 이온 결합을 하여 침전물이 생성되는 것인데요, 이를 염석이라고 합니다.
3~4시간 후 염석이 진행되어 '그림3'과 같이 침전물이 생겼습니다.


충분히 염석이 진행되어 침전물과 액체가 구분될 때 윗부분의 맑은 액체만 스포이트를 사용해 다른 비커에 분리해주었습니다.
스포이트를 통해 액체만 분리해주었지만 침전물이 완전히 분리된 것은 아니기 때문에 거름종이를 통해 침전물을 여러 차례 걸러주었습니다.



'그림6'은 거름종이를 이용하여 침전물들을 거른 용액입니다. 콜라와 우유를 섞었을 뿐인데 상당히 투명한 용액을 얻을 수 있었습니다. 이를 활성탄을 통해 한 번 더 정수하여 투명한 물로 만들어 보겠습니다.
거름종이에 활성탄을 넣어주고 용액을 걸러주는 과정을 반복했습니다.
'그림8'은 활성탄 정수를 마친 용액의 모습입니다. 콜라와 우유에서 시작된 이 용액은 거름종이와 활성탄을 이용한 정수 과정까지 거쳐 깨끗한 물로 재탄생했습니다.
과연 어떤 이유에서 콜라와 우유를 섞으면 깨끗한 물이 되는 것일까요? 지금부터 하나씩 알아보겠습니다!
우선 콜라와 우유는 물이라는 용매에 다양한 용질이 섞여서 만들어진 용액입니다. 이번 실험에서는 용액을 구분할 수 있는 다양한 기준 중 입자의 크기를 기준으로 분류하는 방법을 이해하는 것이 필요합니다.
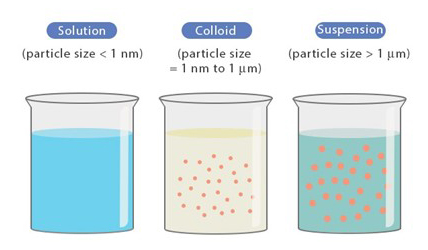
위의 그림은 구성 입자의 크기에 따라서 용액을 크게 세 가지로 분류한 것인데요, 왼쪽부터 차례로 참용액(true solution), 콜로이드 용액(colloidal solution), 현탁액(suspension)이라고 합니다. 모든 구성 입자가 1nm보다 작아 용질이 용매에 완전히 녹아 있는 용액은 참용액, 1nm~1000nm 사이의 입자가 균일하게 퍼져 용매 속을 떠다니는 상태는 콜로이드 용액, 입자의 크기가 1000nm 이상이 되어 입자가 비교적 큰 용액이 현탁액입니다.
참용액의 예시로는 설탕물, 콜로이드 용액은 혈액과 우유, 현탁액은 흙탕물 등이 있는데요, 이번 실험에서는 콜로이드 용액인 우유의 입자들을 콜라를 통해 가라앉히는 현상을 관찰해본 것입니다. 과연 콜로이드 용액의 입자가 비교적 큼에도 불구하고, 가라앉지 않는 이유가 무엇일까요? 그 이유는 바로 구성 입자의 표면 전하에 있습니다.
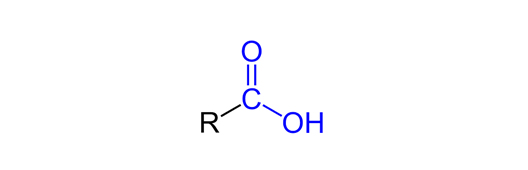
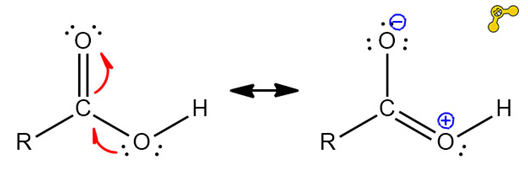
우유의 경우 단백질이 콜로이드 입자로2)용매 속을 떠다니게 되는데요, 단백질은 아미노산3)이 연결된 사슬입니다. 아미노산은 카복실기라는 작용기4)로 이루어져 있는데, '그림10'에 보이는 카복실기(-COOH)의 -OH기에서 O의 높은 전기음성도에 의해 H가 부분적으로 양전하(δ+)를 띠게 됩니다. 이 때, 물(H2O)은 비공유 전자쌍을 가지고 있기 때문에 카복실기에 접근하면 정전기적 인력으로 인해 -OH기의 H가 떨어져 나오게 됩니다. 이 때 수소가 떨어져 나가 생성된 COO-(카복실산 음이온, carboxylate)은 공명 구조를 갖습니다.
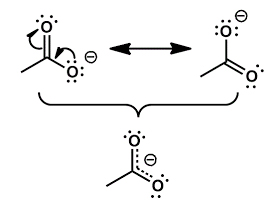
공명 구조란 분자를 하나의 루이스 구조로 정확히 묘사할 수 없을 때 여러 개의 루이스 구조를 동시에 갖는다고 취급하는 것입니다. 카복실기의 경우 이중 결합과 단일 결합이 '그림11'과 같이 두 가지 경우 모두 존재하여 공명 구조를 갖습니다. 이 경우 분자는 1.5중 결합을 갖는다고 하고, '그림12'과 같이 루이스 구조를 표기합니다.
이러한 구조를 가질 경우 구조가 한 가지로 고정되어 있을 때보다 전하가 균형 있게 분포되어 있어 훨씬 높은 안정성을 가집니다. 따라서 H+와 재결합하지 않고 이온화된 상태를 유지하기 때문에 단백질 입자가 표면 전하를 띠게 됩니다.
이 때 발생한 단백질의 표면 전하가 입자 간에 서로 반발을 일으켜서 가라앉지 않고 용매 속을 떠다닐 수 있는 것입니다.
그렇다면 콜라를 넣었을 때 우유 속 단백질들이 가라앉은 이유는 무엇일까요? 그 이유는 간단합니다. 콜라에는 청량감을 높이기 위해 인산과 같은 전해질5)들이 다량 포함되어 있습니다. 콜라에 있던 양이온들이 단백질의 표면 전하와 결합하면 반발력이 사라지고, 단백질이 가라앉게 되는 것이죠. 그런데 염석 과정이 끝난 이후에도 용질이 남아 있는 것을 볼 수 있는데요.
이후 남아있는 용질들은 활성탄을 이용하여 흡착 과정을 거치게 됩니다. 활성탄은 매우 작은 크기의 탄소의 집합체인데, 700℃~1000℃에서 탄소를 산화시켜 활성탄을 제조하는 활성화 과정에서 분자크기 정도의 작은 구멍들이 형성되어 큰 내부 표면적을 갖습니다. 이는 실제 정수 과정에서도 충분히 제거가 되지 않는 요인들을 처리하는 데에 사용되곤 합니다.
지금까지 콜라와 우유를 섞는 간단한 실험을 통해 정수처리과정의 일부를 구현해보고 그 원리를 알아보았는데요, 이제 실제로 어떤 과정을 통해 우리가 사용하는 깨끗한 수돗물을 얻을 수 있는지 함께 알아봅시다.
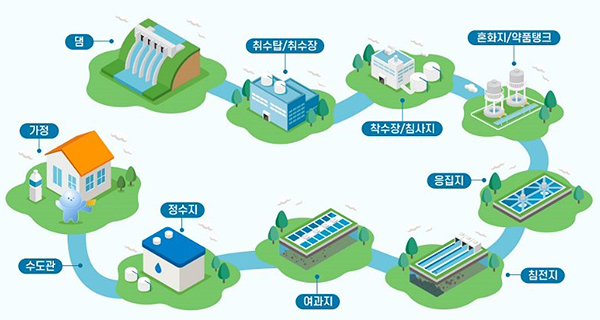
정수 처리 과정은 단순히 거르는 과정이 아니라 다양한 수단을 통해 물속의 이물질을 처리하는 과정을 여러번 반복하는 작업입니다. 우선 저수지, 댐 등의 물을 모아 착수장으로 보내면, 물 속의 모래 등 크기가 큰 입자들을 가라앉힙니다. 이후 혼화지에서 응집제를 주입하여 섞은 후 응집지와 침전지에서 응집된 물질들을 다시 가라앉히는 과정을 거치는데, 실험에서 우유에 콜라를 넣어 섞은 것이 바로 여기에 해당되며 콜라의 전해질은 응집제 역할을 하게 되죠. 여과지와 정수지에서는 아직까지 걸러지지 않은 미세 입자들을 활성탄이나 모래, 자갈층을 이용하여 처리하는 과정을 거칩니다. 실험에서 활성탄을 사용한 것이 바로 이 단계에 해당합니다.
정수하기 정말 힘들 것 같던 두 액체, 콜라와 우유를 섞어 정수를 직접 해내다니 정말 흥미롭지 않은가요? 실제 정수 과정은 이보다 복잡하며, 더 다양한 물질을 사용하여 우리가 일상생활에서 사용하는 물을 만들어낸답니다. 여러분도 집에서 간단한 재료들을 통해 콜라와 우유가 물로 바뀌는 마법을 경험해보는 건 어떨까요? 재미있고 유익한 체험이 되길 바라며 다음 괴짜 공대생의 실험도 기대해주세요!
주석
1) 파란색으로 표시된 부분
2) 콜로이드 용액 속에 균일하게 퍼져 있는 입자
3) 아미노기(-NH2)와 카복실기(-COOH)를 가지는 유기 화합물
4) 유기 화합물의 반응적 특징이나 성질을 결정하는 주요 원자단
5) 수용액 상태에서 이온으로 나뉘는 물질